지엔티파마 ‘크리스데살라진’, 미국 이어 한국·유럽서 루게릭병 희귀의약품 지정
페이지 정보

작성자 GNTPharma
조회 4,785회 작성일 2023-02-27 09:09
본문
지엔티파마 ‘크리스데살라진’, 미국 이어 한국·유럽서 루게릭병 희귀의약품 지정
-크리스데살라진, 임상 1상서 약효·안전성 검증
-전 세계 희귀의약품 시장 연평균 12%씩 성장
-희귀의약품 지정 시 세액 공제, 독점 판매권 등 혜택 받아
신약 개발 기업 지엔티파마는 퇴행성 뇌질환 치료제로 개발하고 있는 ‘크리스데살라진이’ 식품의약품안전처(MFDS)와 유럽 의약품청(EMA)으로부터 루게릭병 치료제 희귀의약품으로 지정됐다고 27일 밝혔다.
크리스데살라진은 지엔티파마가 과학기술정보통신부 ‘21세기 뇌프론티어 연구개발사업’의 지원을 받아 치매, 루게릭병, 파킨슨병 등 퇴행성 뇌질환 치료제로 개발하고 있는 합성신약이다.
퇴행성 뇌질환은 노화와 더불어 신경세포가 점진적으로 사멸하면서 나타나는 난치성 질환으로, 독성인자인 염증과 활성산소가 뇌에 쌓이면서 발생한다.
크리스데살라진은 염증 유발 단백질 mPGES-1의 작용을 막아 염증인자 프로스타글란딘 E2(PGE₂) 생성을 억제하고, 강력한 자유 라디칼 포착 작용으로 활성산소를 제거하는 이중표적 뇌세포 보호 약물이다.
크리스데살라진은 루게릭병 동물모델에서 척수 운동신경세포의 사멸을 막고, 장애를 개선하며, 생명을 연장하는 효과가 비교 약물들에 비해 우수하고 안전한 것으로 밝혀졌다. 노인을 포함한 건강한 성인 72명을 대상으로 완료한 임상 1상에서 크리스데살라진은 예상 약효 용량의 6배인 600mg을 경구 투여해도 안전했다.
루게릭병으로 알려진 근위축성측색경화증은 뇌척수 운동신경세포가 점진적으로 퇴화하고 사멸하는 것이 특징인 퇴행성 뇌질환이다. 근육 약화가 나타나고 시간이 지나면서 먹고, 말하고, 숨 쉬는 수의운동에 장애가 생기는 질환으로 대부분의 환자는 발병 후 3~5년 사이에 호흡부전으로 사망에 이르게 된다.
현재 전 세계 제약산업을 주도하는 미국·유럽의 제약회사, 규제기관, 연구기관은 혁신적인 루게릭병 치료제 개발을 위해 막대한 투자를 아끼지 않고 있다.
지엔티파마는 크리스데살라진이 지난해 미국 식품의약청(FDA)으로부터 루게릭병 희귀의약품으로 지정된 데 이어 이번에 MFDS와 EMA로부터 루게릭병 희귀의약품으로 지정됨에 따라 글로벌 신약 개발에 더욱 탄력을 받게 됐다.
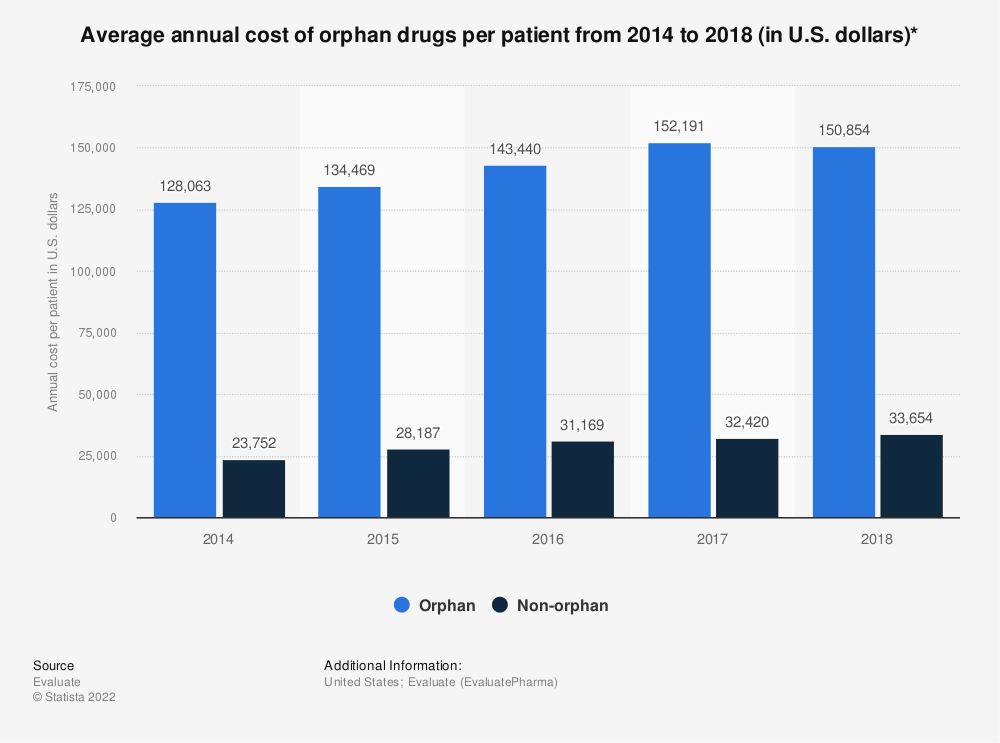
2018년 기준 미국에서 일반 전문의약품의 연간 평균 환자 부담 비용은 약 3만3654달러(약 4400만원)였고, 희귀질환 의약품은 약 15만854달러(약 2억원)로 4.48배 높았다. 전 세계 희귀질환 신약 파이프라인의 수가 급증하고 희귀의약품 시장이 연평균 12%씩 성장하고 있는 이유다.
희귀의약품으로 지정되면 임상시험계획서 설계 자문, 심사 비용 감면, 세액 공제, 우선심사, 독점 판매권 등 다양한 혜택을 받게 된다. 이러한 지원으로 희귀질환 신약 개발 비용은 대폭 줄어들었고, 임상 1상에서 신약 승인까지 성공 확률은 17%로 일반 신약의 2배를 넘는다.
지엔티파마 곽병주 대표이사(연세대학교 생명과학부 겸임교수)는 “미국 FDA에 이어 한국 MFDS와 유럽 EMA에서 크리스데살라진의 이중표적 뇌세포 보호 작용, 루게릭병 동물모델에서의 약효, 사람에서의 안전성 등을 종합적으로 평가해 희귀의약품으로 지정했다”며 “크리스데살라진이 혁신적인 루게릭병 치료제로 개발될 수 있도록 약효 검증을 위한 최적의 임상시험을 차질 없이 진행할 것”이라고 말했다.
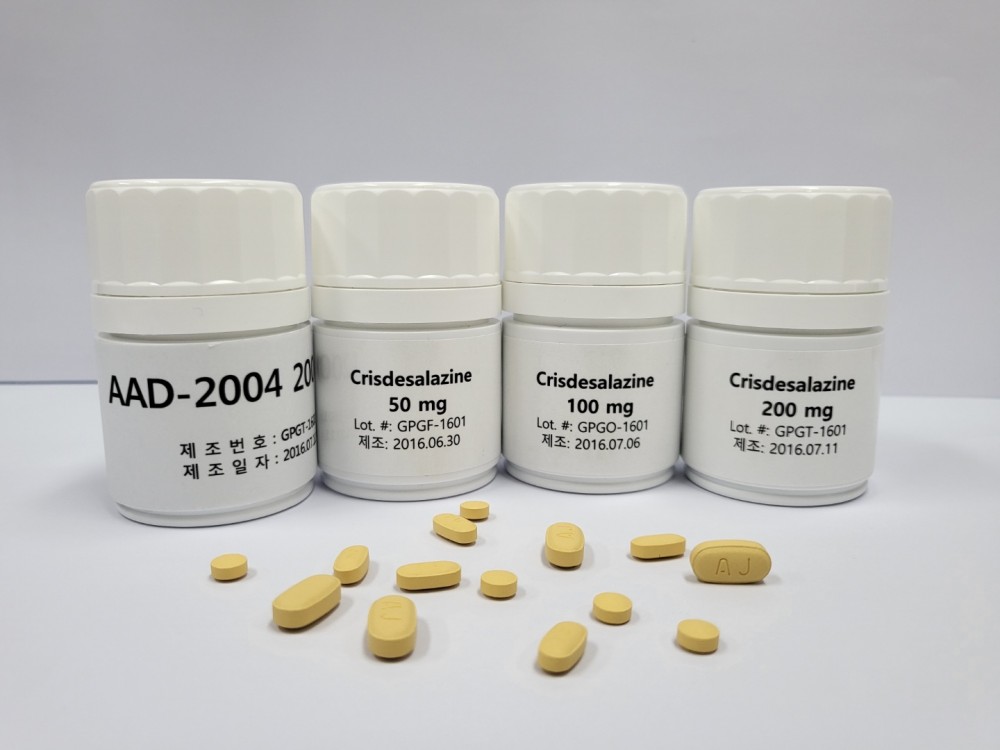 지엔티파마가 알츠하이머 치매, 루게릭병 등 퇴행성 뇌질환 치료제로 개발 중인 ‘크리스데살라진’.
지엔티파마가 알츠하이머 치매, 루게릭병 등 퇴행성 뇌질환 치료제로 개발 중인 ‘크리스데살라진’.
- 이전글지엔티파마, ‘넬로넴다즈’ 심정지 임상 2상 환자 등록 완료…국내 최초 23.03.08
- 다음글지엔티파마, 뇌졸중 신약 효과·안전성 확인…국제컨퍼런스서 임상 진행 상황 발표 23.02.14


