지엔티파마, 국내 최초 뇌졸중 신약 ‘넬로넴다즈’ 임상 3상 환자 등록 완료
페이지 정보

작성자 GNTPharma
조회 5,144회 작성일 2023-04-11 08:00
본문
지엔티파마, 국내 최초 뇌졸중 신약 ‘넬로넴다즈’ 임상 3상 환자 등록 완료
-허혈성 뇌 손상 방지에 최적화된 최초의 다중표적 뇌세포 보호 신약
-뇌졸중 임상 2상서 안전성, 장애 개선 효과 확인…내년 치료제 출시
-환자 등록 예정보다 1년 이상 앞당겨, 임상 3상 주요 결과 4분기 공개 예정
신약 개발 기업 지엔티파마(대표이사 곽병주)는 뇌졸중 치료제로 개발 중인 ‘넬로넴다즈’의 임상 3상 환자 등록을 완료했다고 11일 밝혔다. 임상 주요 결과는 오는 4분기에 공개될 예정이다.
국내 처음으로 식품의약품안전처의 승인을 받아 진행된 임상 3상은 12시간 이내에 동맥 내 혈전제거술을 받는 중증 뇌졸중 환자에게서 넬로넴다즈의 장애 개선 효과를 검증하는 것으로, 목표 환자 496명의 등록을 마쳤다.
지엔티파마는 “전국 24개 대학병원 뇌졸중 센터에서 임상시험이 순조롭게 진행되면서 당초 예정했던 2024년 6월보다 1년 이상 빠르게 마지막 환자에 대한 투약이 마무리됐다. 임상 3상 결과에 따라 내년 하반기 치료제를 출시할 계획”이라고 밝혔다.
뇌졸중은 뇌로 가는 혈관이 막히거나 터져서 뇌세포가 죽는 질환으로 세계적으로 연간 1,500만명의 환자가 발생한다. 1990년 이후 수많은 뇌세포 보호 약물이 개발돼 뇌졸중 환자를 대상으로 임상시험을 진행해왔으나 부작용과 약효 부재로 모두 실패했다.
2015년 혈전제거술이 뇌졸중 환자의 재개통 치료에 성공적으로 도입됐으며 지엔티파마는 8시간 이내에 혈전제거술을 받은 뇌졸중 환자 209명을 대상으로 뇌세포 보호 약물의 임상 2상을 최초로 진행했다.
임상 2상 결과, 5일 동안 저용량(2,750mg) 또는 고용량(5,250mg) 넬로넴다즈를 투여받은 뇌졸중 환자에게서 안전성은 물론 장애 개선 효과가 확인됐다. 특히 고용량 넬로넴다즈를 투여받은 중증 뇌졸중 환자 중 90일 후에 장애 증상이 없는 환자와 독립활동이 가능한 환자의 비율은 확연히 높아졌다.
이번 임상 3상의 1차 유효성 평가 지표는 뇌졸중 환자의 장애를 평가하는 수정랭킨척도(mRS, modified Rankin Scale)의 점수분포로, 장애 개선 효과를 검증한다. 2차 유효성 평가 지표는 △독립활동이 가능한 환자의 비율 증가 △장애 증상이 없는 환자의 비율 증가 △뇌경색 방지 효과 △증상성 뇌출혈(혈전제거술의 주요 부작용) 방지 효과로, 위약 대비 약효를 검증한다. 마지막 투약 환자에 대한 관찰은 7월 초에 종료될 예정이다.
지엔티파마가 과학기술정보통신부와 경기도 등의 지원을 받아 개발한 넬로넴다즈는 NMDA 수용체 활성을 억제하고 동시에 활성산소를 제거하는 신물질로, 뇌졸중 후 뇌세포 사멸을 방지하는 세계 최초 ‘다중표적’ 뇌세포 보호 약물이다.
뇌졸중은 크게 심정지에 의한 전뇌 허혈과 뇌혈전에 의한 국소 뇌허혈의 형태로 발생하는데, 심정지 및 국소 뇌허혈 동물모델에서 넬로넴다즈의 탁월한 약효가 입증돼 임상 결과가 최근 국제 학술지에 잇달아 게재됐다.
곽병주 지엔티파마 대표이사(연세대학교 생명과학부 겸임교수)는 “지난달 4시간 이내에 자가순환이 재개된 심정지 환자를 대상으로 허혈성 뇌 손상 방지 효과를 검증하는 임상 2상 환자 등록을 완료한 데 이어 이번에 혈전제거술을 받은 국소 뇌허혈 환자를 대상으로 임상 3상 환자 등록을 완료함에 따라 연내에 뇌졸중 유형에 따른 넬로넴다즈의 약효와 안전성을 폭넓게 검증할 수 있게 됐다”고 말했다.
이어 “뇌졸중 임상 2상에서 넬로넴다즈의 안전성과 약효가 확인된 만큼 심정지 임상 2상과 뇌졸중 임상 3상에서 넬로넴다즈의 약효가 검증될 것으로 기대하며, 4분기에는 임상시험의 주요 결과를 확인할 수 있을 것”이라고 밝혔다.
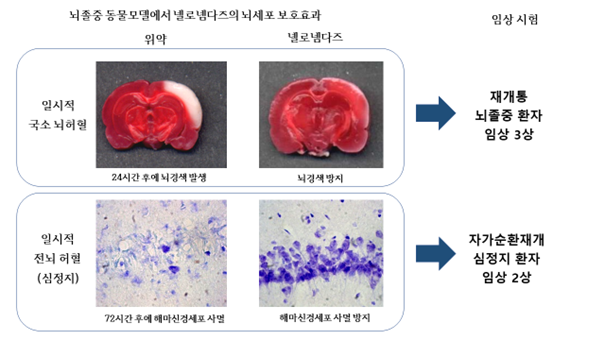
뇌졸중 동물모델에서 넬로넴다즈의 뇌세포 보호 효과.
- 이전글지엔티파마, COPD·천식 치료제 ‘플루살라진’ 임상 1상 IND 신청 23.05.03
- 다음글지엔티파마, ‘넬로넴다즈’ 심정지 임상 2상 환자 등록 완료…국내 최초 23.03.08