지엔티파마, 뇌졸중치료제 'Neu2000' 국내 임상 2상돌입
페이지 정보

작성자 GNTPharma
조회 13,569회 작성일 2016-05-11 16:19
본문
http://news.mtn.co.kr/newscenter/news_viewer.mtn?gidx=2016051113495971956
??
지엔티파마, 뇌졸중치료제 'NEU2000' 국내 최초 임상 2상 돌입
[머니투데이방송 MTN 정희영 기자]
신약개발 전문기업 지엔티파마가 개발중인 뇌졸중 치료제의 임상 2상을 본격 개시한다.
지엔티파마는 최근 신약1호로 개발중인 뇌졸중 치료제 'Neu2000'의 약효입증을 위한 임상 2상 연구를 식품의약품안전처(MFDS)로부터 승인받았다고 11일 밝혔다.
지엔티파마는 최근 신약1호로 개발중인 뇌졸중 치료제 'Neu2000'의 약효입증을 위한 임상 2상 연구를 식품의약품안전처(MFDS)로부터 승인받았다고 11일 밝혔다.
Neu2000은 뇌졸중 치료 가능시간을 획기적으로 연장할 수 있는 전세계적으로 유일한 신약후보물질이다.
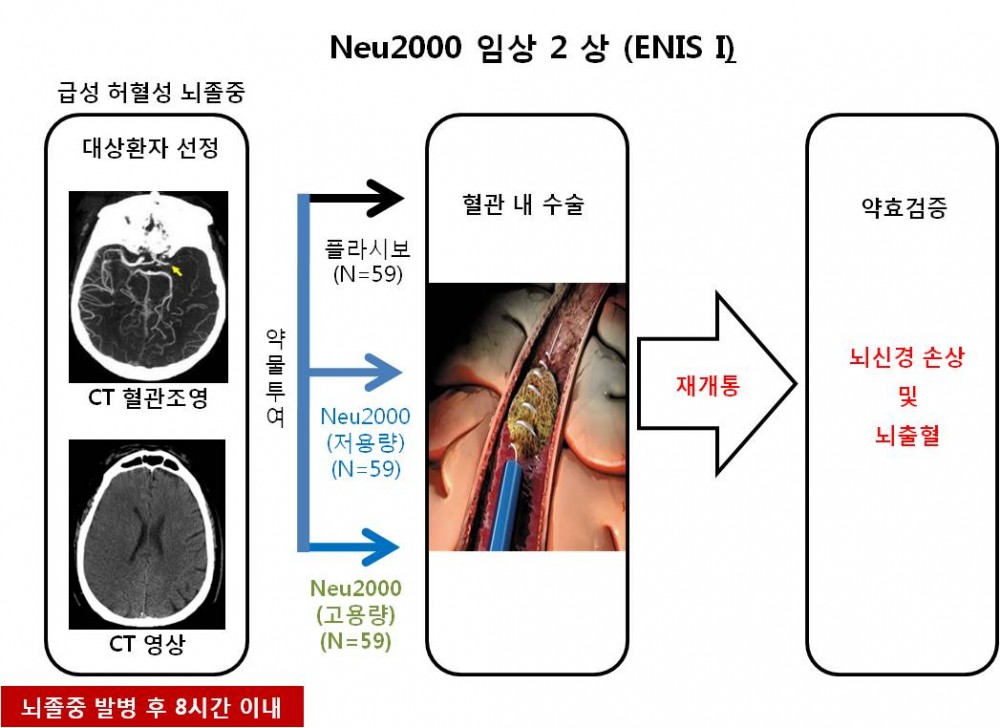
이번 임상 2상 연구는 뇌세포보호신약의 약효를 검증하기 위한 최초의 임상연구로 혈관 재개통 치료를 받는 허혈성 뇌졸중 환자를 대상으로 진행한다.
아주대병원을 중심으로 경북대병원, 가천대병원, 계명대병원, 조선대병원, 충북대병원에서 204명의 환자를 대상으로 Neu2000의 뇌졸중 임상연구를 수행할 예정이다. 지엔티파마는 미국에 이어 지난해 중국에서 노인을 포함한 165명의 정상인을 대상으로 Neu2000의 임상 1상 연구를 완료해 안전성을 입증 받았다.
Neu2000은 뇌졸중 발병 후 뇌세포의 손상을 유발하는 물질인 글루타메이트의 흥분독성과 활성산소의 독성을 동시에 억제하는 세계 최초의 다중표적약물(Multi-target drug)이다.
특히 뇌졸중 동물모델에서 글루타메이트 흥분독성 NMDA 수용체 억제제나 활성산소 억제를 위한 항산화제를 단독으로 투여했을 때보다 뇌손상을 줄이는 약효가 탁월하며 일시적 허혈 동물모델에 8시간 이내에 투여할 경우 의미있는 효과가 입증됐다고 회사 측은 설명했다.
이번 임상에서는 뇌졸중 발병 후 신속한 CT 촬영을 통해 8시간 이내에 혈관 재개통 치료를 받는 환자를 대상으로 Neu2000을 5일 동안 투여하고 12주에 걸쳐 장애의 정도, 뇌졸중 지수, 일상생활 수행능력, 뇌출혈 등을 분석하여 약효를 평가한다.
곽병주 지엔티파마 대표는 "지난 20여년간 뇌세포보호신약들을 대상으로 200여회 이상의 뇌졸중 임상연구를 진행했지만 정상인에게서 심각한 부작용이 발생했고 골든타임이 짧아서 대부분 실패했다"며 "그만큼 개발이 어려운 분야이기 때문에 이번 임상2상 연구의 의미가 크다"고 말했다.
지엔티파마는 지난 1998년 뇌신경과학, 약리학, 안과학 및 세포생물학 분야의 연구자 8명의 교수들이 모여 설립한 신약개발기업이다. 현재 뇌졸중 치료제 'Neu2000'을 개발중인 이 회사는 2014년 중국 500대 그룹에 속하는 헹디안그룹 아펠로아제약(중국1호 민영화기업)을 통해 중국에서도 임상2상 승인을 신청했다. 국내에서는 올해 안에 임상 2상 연구를 완료하는 것이 목표다.
[머니투데이방송 MTN = 정희영 기자 (hee082@mtn.co.kr)]
[아주경제] 지엔티파마, 뇌졸중 신약 임상2상 승인 (05.11)
[전자신문] 지엔티파마, 뇌졸중 치료제 임상 2상 돌입 (05.11)?
[아시아경제] 지엔티파마, 뇌졸증 치료신약 임상 2상 돌입 (05.11)
[파이낸셜뉴스] 지엔티파마, 뇌졸중치료제 국내 임상 2상 돌입 (05.11)
[디지털타임스] 지엔티파마, 뇌졸중치료제 국내 최초 임상 2상 돌입 (05.11)
[뉴스토마토] 지엔티파마, 뇌졸중치료 신약 2상 돌입 (05.11)
[머니투데이방송] 지엔티파마, 뇌졸중치료제 'Neu2000' 국내 최초 임상 2상 돌입 (05.11)
[아이팜뉴스] 지엔티, 뇌졸중치료제 임상2상 돌입 (05.12)
[이뉴스투데이] 지엔티파마, 뇌졸중치료제 임상 2상 돌입…‘신약개발 박차’ (05.12)
- 이전글[한국경제매거진] 곽병주 지엔티파마 대표 , 뇌졸중 치료제 임상 2상 시작 16.05.18
- 다음글[파워인터뷰 The CEO]곽병주 지엔티파마 대표이사 16.04.07